تكافؤ الكتلة و الطاقة:معادلة اينشتاين الشهيرة
توصل Albert Einstienألبرت أينشتاين إلى معادلته الشهيرة E = mc2 ( حيث E هي الطاقة , و m هي كتلة الجسم , و c هي سرعة الضوء ) و ذلك أثناء بلورته لنظرية النسبية . و من بين كل معادلات الفيزياء ربما كانت هذه المعادلة أكثرها بساطة و من ثم أكثرها شهرة بين عامة الناس .
و لكن ماذا تعني هذه العبارة البسيطة و العميقة في آن واحد ; E=mc2 ؟
تقول هذه العبارة أن هناك طاقة مرتبطة بوجود المادة فمثلا كمية الطاقة التي تمتلكها كتلة مقدارها 1 كيلو جرام هي كمية هائلة من الطاقة !و لكن إجراء هذه العملية الحسابية لا يعطي أي فكرة متعمقة عن صورة هذه الطاقة أو كيفية تفسير هذه المعادلة .
مم تتركب المادة؟
قد يكون من المفيد في هذا الشأن النظر بإمعان إلى تركيب المادة . تتكون المواد التي نتعامل معها في حياتنا اليومية من ذرات مختلف العناصر الكيميائية المترابطة مع بعضها البعض في صورة جزيئات بقوى كهرومغناطيسية , و يمكن أن تتغير البنية الجزيئية للمادة نتيجة للتفاعلات الكيميائية كالاحتراق مثلاً أو الأكسدة .
و عند ترتيب الذرات على هيئة جزيات تبذل قوى الترابط شغلاً و هذا يؤدي إلى تغير طاقة جهد النظام ( طاقة الجهد تنشأ نتيجة لمواضع أو هيئة الأجسام المتفاعلة ) . و عليه فإن التغير في البنية الجزيئية هو تغير في الهيئة , و يمثل بالتالي تغير في طاقة جهد الجزئ , و هو ما يسمى بطاقة الارتباط .
عندما تكون الذرات في البنية الجزيئية الجديدة أشد ترابطاً مما كانت قبل إعادة توزيعها تقل طاقة جهد النظام , و تنبعث الطاقة من النظام في صورة حرارة أو ضوء عادة ً . أما إذا كان التفاعل ينتج جزيئات جديدة ذات ذرات أقل ارتباطاً فإن النظام لابد أن يكتسب بعض الطاقة , ربما في صورة حرارة .
عندما تكون الذرات في البنية الجزيئية الجديدة أشد ترابطاً مما كانت قبل إعادة توزيعها تقل طاقة جهد النظام , و تنبعث الطاقة من النظام في صورة حرارة أو ضوء عادة ً . أما إذا كان التفاعل ينتج جزيئات جديدة ذات ذرات أقل ارتباطاً فإن النظام لابد أن يكتسب بعض الطاقة , ربما في صورة حرارة .
تكافؤ الكتلة و الطاقة
تعني معادلة أينشتاين التي تربط الكتلة بالطاقة أن التغيرات في طاقة النظام يصحبها تغيرات في كتلة النظام و يمكن كتابة المعادلة E = mc2 في الصورة البديلة الآتية :
𝛥m = ∆E/c²
من المعلوم أن القيمة النمطية للطاقة المتحررة نتيجة الاحتراق الكامل لأنواع الوقود العادي هي 10 مرفوعة للأس 7 جول لكل كيلوجرام من المادة الداخلة في التفاعل ( الوقود زائد الأكسجين ) .بماذا تخبرنا معادلة أينشتاين عن مقدار التغير في كتلة كل كيلوجرام من المادة عند احتراقه ؟؟
تخبرنا المعادلة السابقة أن التفاعل الكيميائي النمطي يمكن أن يغير كتلة المواد المتفاعلة بما يعادل جزء واحد من عشرة بلايين جزء ! و هذا التغير في الكتلة لا يمكن بأكثر الطرق دقة في الوقت الحالي .
و هكذا فإننا في خبراتنا اليومية مع التفاعلات الكيميائية لا نشعر بأي تغير في الكتلة .
ماذا عن التفاعلات النووية؟
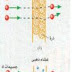
و لكن عند دراسة الأنوية الذرية سنجد أن البروتونات و النيوترونات مترابطة مع بعضها بقوى ترابط نووي أشد كثيراً من القوى الكهرومغناطيسية بين الذرات .كذلك فإن التفاعلات الكيميائية لا تغير هذه البنية النووية و لكن التفاعلات النووية كالانشطار و الاندماج النووي تغيرها. و الانشطار Fission هو عملية تنشق فيها النوى الثقيلة كاليورانيوم و البلوتونيوم إلى شظايا أخف , و هي مصدر الطاقة في المفاعلات النووية الحالية .
أما الاندماج Fussion فيتضمن التصاق و اندماج الأنوية الخفيفة مكونة بنية نووية أكثر تعقيداً . و من أهم التفاعلات النووية الاندماجية اندماج أربعة أنوية هيدروجين لتكوين نواة هيليوم واحدة . و هذا هو المصدر الرئيس لتوليد الطاقة في الشمس .
نفهم من ذلك أن النقص في الكتلة يتحول إلى طاقة.
عند قياس الكتلة الكلية قبل و بعد التفاعل النووي سوف نجد أنها قد نقصت نقصا كبيرا
عند قياس الكتلة الكلية قبل و بعد التفاعل النووي سوف نجد أنها قد نقصت نقصا كبيرا



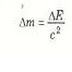



ليست هناك تعليقات: